キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。 2.原理 金属イオンに配位し、キレート化合物を形成する多座配位子をキレート試薬と呼ぶ。こ容量分析法に応用した 「キレート滴定法」を確立した。こ の方法は,現在では主に水の硬度を決定するためのCa2 亠 及びMg2 + の滴定法として知られ,大学基礎課程における 化学実験等でも広く実施されてい るが,それ以外の 金属イ2、若含本項干擾物質會高估硬度值。 (二)懸浮或膠體有機物質也會干擾滴定終點,可將25 mL或適量水 樣在水蒸氣浴上蒸乾,然後在550 ℃之高溫爐中加熱至有機物 質全部被氧化。將殘渣溶於 mL 1 N鹽酸中,再以1N 之氫 氧化鈉溶液中和至pH 7,以蒸餾水稀釋至50 mL,冷卻至室 溫,再依七
水の硬度 株式会社ユニケミー ユニラボ
キレート滴定 水の硬度 計算
キレート滴定 水の硬度 計算-全硬度の測定は、試料水のpHを約10に調整した後,BT指示薬を加えて、EDTA溶液で滴定して求める。 BT指示薬はpH10付近では青色を呈するが、Ca 2+ 、Mg 2+ などの金属イオンを含む溶液中に加えるとキレート化合物を生成し、赤紫色を呈する。水の硬度について こんばんは。実は実習で硬度について勉強し 水の硬度測定 水の硬度測定(キレート滴定による) 水の全硬度の計算式? キレート滴定でミネラルウォーターに 薬剤師国家試験 第99回 問23 過去問解説 erec




ファクター 求め方
EDTA と金属キレートのK f 値→p18, 表12 <例:EDTA とMg2> K f = 49×108 log K f = 8 log 49 = 869 ML n M Ln 8 キレート滴定 多座配位子EDTA(標準液)が 金属イオン(Zn 2, Mg 2, Ca , Al3, Cu 等)と 水溶液中で安定な可溶性のキレート化合物を生成する ことを利用した入れ滴定を行う。赤紫色から青色に変色したと ころを終点とする。 ⑥ ①~⑤を3回繰り返し、滴定平均値を求める。 ⑦ Ca硬度を計算し求める。 計算式は以下のとおりである。 Ca硬度 B=滴定平均 F=力価(EDTA・2Na 採取量3 Ca硬度の測定とMg硬度の計算 1) 試料水50mlを、ホールピペットを用いてコニカルビーカーに正確にとる。 2) pH12緩衝溶液を駒込ピペットで5ml加える。 3) Na 2 S溶液を駒込ピペットで2ml加え、約2分間放置する。 4)
· 総硬度の滴定の練習にCaの標準液を用いました。 Ca硬度の測定のためではないのです。 濃度計算も間違っていないし、簡単な組成で阻害されているようで不可解なので質問させていただきました。 No A5 Re原子吸光用Ca標準液を用いた硬度の測定 1801 yone (ZWl7d2 pH10でのEBT · キレート滴定の硬度の計算について考えています。 ミネラルウォーター50cm3を試料にedta溶液でキレート滴定をしたのですが、 硬度の計算がわからなかったため、知恵袋で検索していたところ、方法が2つ キレー ト滴定法は, 金属キレー ト錯体の生成反応を利用して,金属イオンを定量する方法である。 たとえば,水道水など飲料水中に含まれるマグネシウムおよびカルシウムイオン濃度, すなわち,水の硬度はEDTAを用いるキレー ト滴定によって簡単に測定できる。EDTA の他にも多数のキレート滴定剤および指示薬が開発され,大部分の金属イオンが滴定法によって定量できるようになった。
(試料水 + ph 10緩衝液 + ebt指示薬)をedta溶液で滴定する。 3.ca硬度の測定(ca2+ 濃度をcaco 3の質量に換算してmg/lで表す) (試料水 + koh水溶液 + nn指示薬)をedta溶液で滴定する。 · キレート滴定でミネラルウォーターに含まれるCa2とMg2の濃度の和(mol/L)を求めたのですが、ここから硬度を計算する方法がわかりません。 濃度(mol/L)×5608(CaOの式量)× (100/1000)(ml)×1000(mg)=硬度(度)・Happy Belly 岐阜・養老 天然水(硬度15) ・四季の恵み 自然湧水 岐阜・養老(硬度15) ・サンタンナ イタリアアルプス 天然水(硬度81) ・温泉水99(硬度17) 日本で取り扱っているのは基本的に軟水が多いと分かりますね。 軟水と硬水それぞれの特徴と違い 硬水は、硬度が1mg以上で、軟水




Woa1 Detergent Composition For Fibres Google Patents
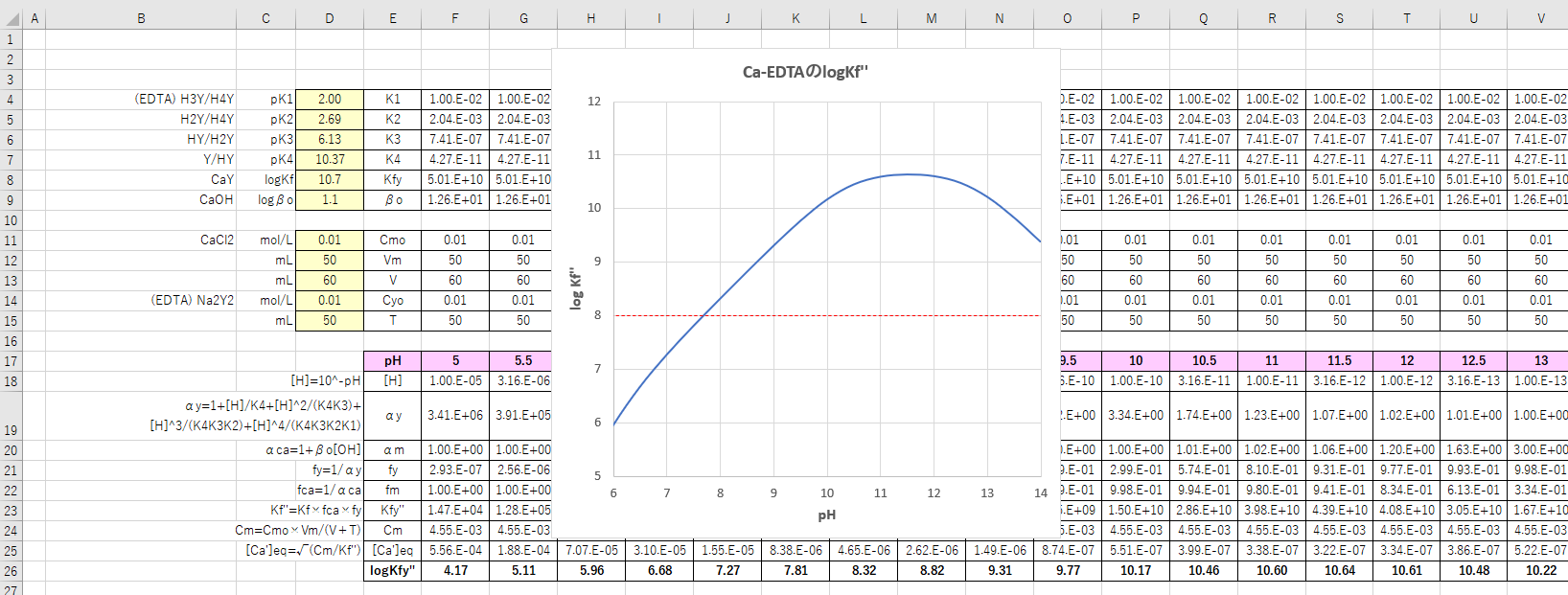



Edta 滴定曲線 溶解度などーエクセルを用いて
硬度(mg/L) = 100×(EDTAモル濃度〔mol/L〕)×(EDTA滴下量〔mL〕)×1000÷(検水量〔mL〕) となる。 例えば, mol/LのEDTA水溶液を用いて,検水0 mLを滴定したところ,130 mL加えたところで反応が完了したならば,硬度 = 100××130×1000÷0 = 650 ということになる。となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが「水の硬度測定(全硬度,カルシウム硬度) 」 Key words:キレート滴定、キレート試薬、硬度 全硬度滴定 前 滴定後 カルシウム硬度滴定前 滴定後 実験を行う上で観察して欲しいところや注意事項 ① 硝酸銀の取り扱いに注意!保護メガネ着用のこと!!! ② 実験室内のものは絶対に口にし




Images Of キレート滴定 Japaneseclass Jp




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog
キレート滴定で求めた硬度と全アルカリ度を比較せよ。 *1 炭酸水素塩の形で溶存しているカルシウム・マグネシウムは、 水を煮沸することによってかなりの程度、炭酸塩の沈殿として除くことができる。 これを一時硬度(炭酸塩硬度とも)と呼ぶ。全 · 今回の実験での硬度の算出方法は、次のキレート滴定の章に記載するので、そちらを参照してください。 次に、飲料水の硬水と軟水の違いについて説明します。 日本では一般的に、硬度100以上の水を硬水、硬度100以下の水を軟水としています。また、whoでは、硬度60以上の水を硬水、硬度60以下の水を軟水としています。今回の実験は日本で行われていると思うので · EDTA溶液002mol キレート滴定の実験で行った水の硬度の求め方について 大学でキレート滴定の実験を行ったんですが水の硬度がうまく計算できなくて教えていただきたいです 大学では アメリカ硬度=検液のモル濃度××1000 ドイツ硬度=検液のモル濃度×5608×1000×(100÷1000) で習ったんですがこの式を使ってもうまく求められません これを教




ブログ 学校のいまを知る 専門学校 東京テクニカルカレッジ




スイッチ専用強化 ガラスフィルム 人気ショップが最安値挑戦 硬度9h 送料無料 Nintendo Switch 日本旭硝子素材 ガラス飛散防止 スイッチガラスフィルム 任天堂 0 3mm極薄保護ガラスフィルム 指紋防止 強化保護ガラス
キレート 滴定法 により 試料水中 のCa 及びMg の定量 を行うことにより 試料水 の各硬度 を求め、 測定結果報告書 を制限時間内 (150 分)に提出 する 。 <手順 > (1)EDTA ・2Na を秤量 びんを 用いてはかりとり 、正確 に秤量 する 。 (2)500mL メスフラスコ に001mol/LEDTA 標準溶液 を調製 する · 水の硬度測定(キレート滴定)での硬度計算の定数1001は何故こ数字なんですか? 質問日時: /2/25 1444 回答数: 1 閲覧数: 98 教養と学問、サイエンス > サイエンス > 化学水に学ぶ~硬度計算は簡単! お水に魅せられ、04年にお水の総合商社を立ち上げられた堀内拓矢さん。国内外のお水に精通する堀内さんに、意外と知られていないお水の基礎知識を教えていただきます。 水に学ぶ~硬度計算は簡単!~ では、次に具体的に硬度
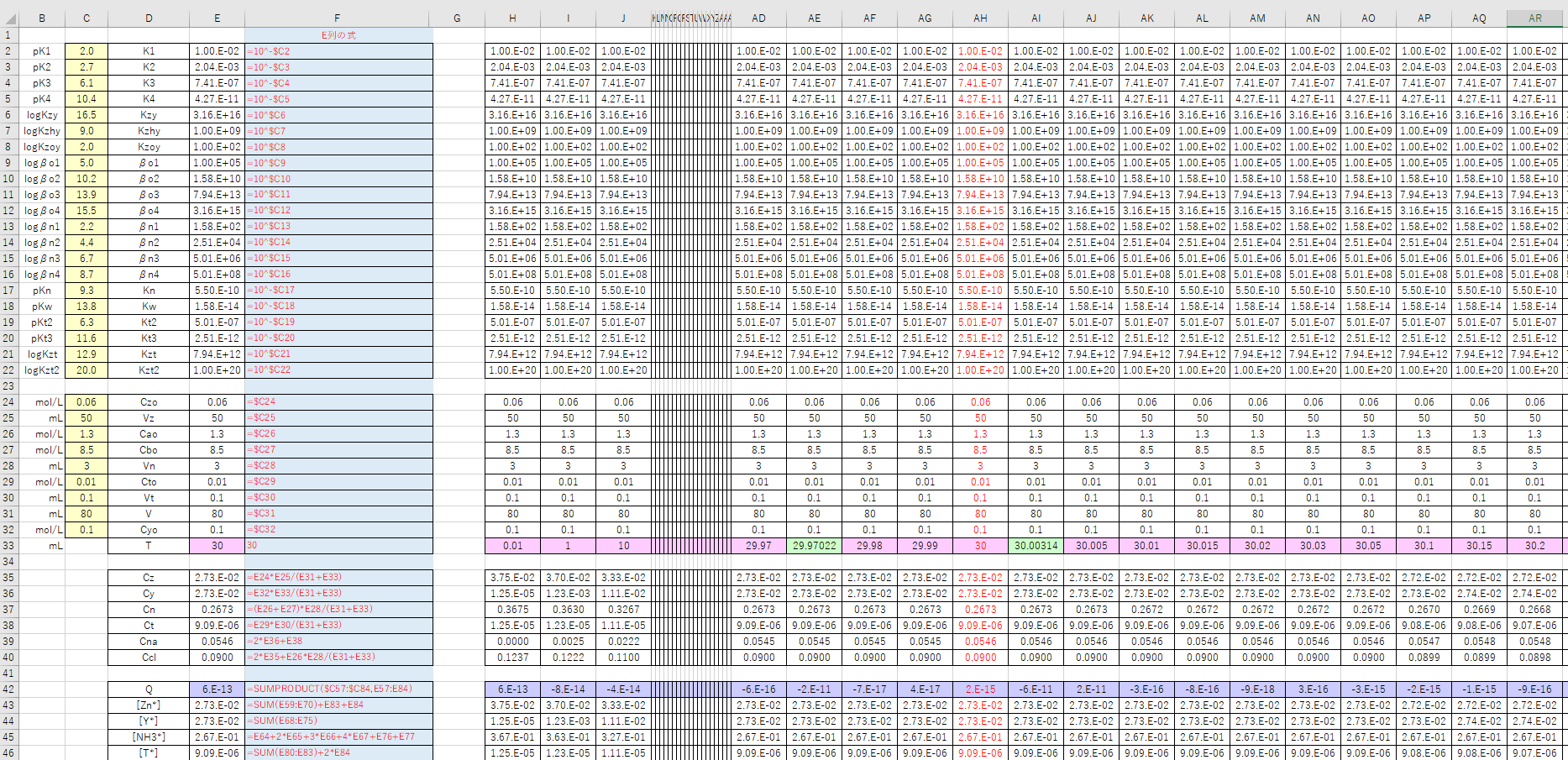



Edta 滴定曲線 溶解度などーエクセルを用いて




ファクター 求め方
0.01M-EDTA標準溶液で滴定 ← ビュレットに入れる ↓ (3回以上繰り返し) ↓ 全硬度の計算京都大学 全学共通教育 基礎化学実験ホームページ:http//wwwchemzenkyohkyotouacjp/化学実験操作法:操作法 2 4 キレート水の硬度とは、「水中のカルシウムおよびマグネシウムの量をこれに対応する炭酸カルシウムの濃度(mg/l)に換算して表したもの。」と定義されている。 この実験で得られる総硬度は以下のように算出する。 硬 度 = EDTAの滴定量 × 1000/試料100ml (硬度は1リットル中の量として表すため1000




化石の購読についてのお知らせ 0 予約購読料 1 年分 年 2 回発行 古生物学会会員 非会員 1000 円 10 円 0 お申込みと送金は下記へ 980 仙台市青築山 東北大学理学部地質学古生物学教室内 化石編集部 振替口座仙台 番 バックナンバーの在庫の Pdf Free Download



尿素水分析 ユニラボ 愛知 名古屋の理化学分析試験専門会社ユニケミー
· 水の硬度を測定する方法は EDTA(エチレンジアミン四酢酸) というキレート剤を使用するため、EDTA法と呼ばれます。 EDTA法の原理はEDTAが試料中のCaやMgとEDTAは11で結合する ので、結合したEDTAの量を調べるとCaとMgの量が分かるという法則に基づきます。キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。計算式 硬度(mg/L)=Ca(mg/L)×2497 + Mg(mg/L) × 4118 ;




硬度1500mg Lのかた い水がある 水の硬度測定 バイオ科 応用バイオ化学実験 分析化学 2年 036 ブログ 学校のいまを知る 専門学校 東京テクニカルカレッジ
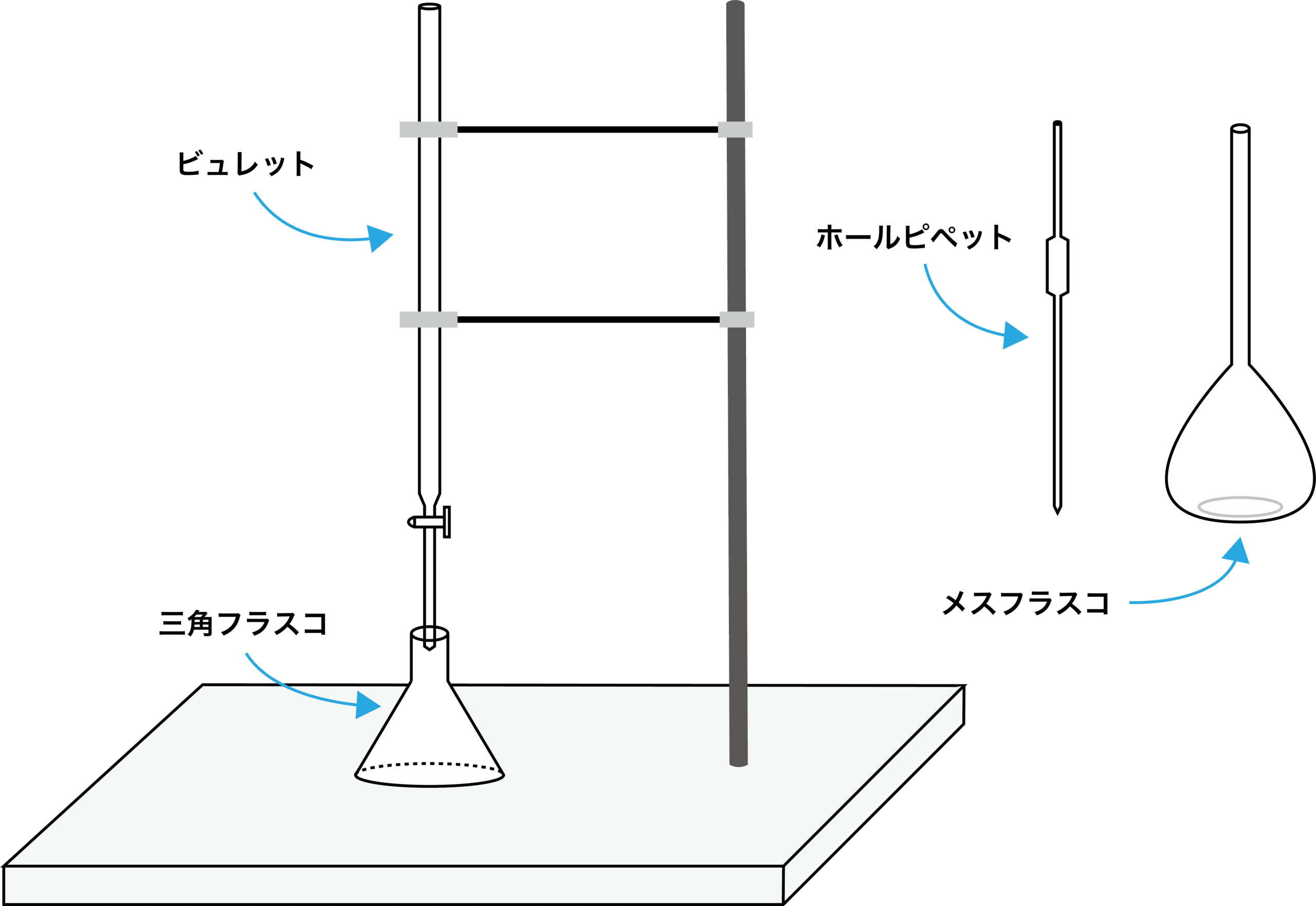



Images Of キレート滴定 Japaneseclass Jp
· 硬度の測定方法は、まず、エチレンジアミン 四酢酸(edta)によるキレート滴定法が一般 的です。キレートとはラテン語で蟹の爪の意 味で、edta がカルシウムやマグネシウムな どの金属イオンを蟹が爪ではさむようにして出来る結 合体を指します。(図1) edtaはカルシウムやマグネシウムのイオンと1対 1 で反応します。そのためキレート形成に必要な edta の量が分かれば方法が広く用いられている。これをキレート滴定という(参考(1)参照)。ここでは水の硬度測定すなわちCa2,Mg2の濃度を キレート滴定によって定量する方法を理解する2)。 < 要 点 > 硬度とは水中のCa2およびMg2の量をCaCO 3(mg CaCO3/L)に換算したものである。硬度には全硬度13年6月29日(土) 水の硬度測定 化学グランプリを受験する生徒のための第2回目の講習として、水の硬度測定を実施した。 エチレンジアミン四酢酸二ナトリウム水溶液とpH10緩衝溶液,BT指示薬を用いて全硬度を測定し、次にpH12緩衝溶液,NN 指示薬を使い、Ca硬度を測定し、Mg硬度を計算で求




Mbaheblogjpxy1z 無料でダウンロード キレート滴定 Ph キレート滴定 Ph 理由




Woa1 Detergent Composition For Fibres Google Patents
(キレート滴定編) 181 日本工業化学教育研究会 高校生ものづくりコンテスト化学分析部門研究委員会 18 年版 本テキストを制作するにあたり 日本工業化学教育研究会 会長 愛知県立愛知工業高等学校長 蜂須賀 豊 日本工業化学教育研究会の皆様におかれましては、日頃より本会の充実水の硬度測定(キレート滴定による) 水の硬度測定 Coocan 4.Ca硬度の測定とMg硬度の計算 ①試料水50mL を、ホールピペットを用いてコニカルビーカーに正確にとる。②pH12 緩衝溶洷を駒込ピペットで5mL 加える。③5%Na2S水溶洷を駒込ピペットで2mL 加えるEDTAは水にほとんど溶けないので、キレート滴定では水に溶けやすいEDTA ・2Naを用いる。 全硬度の測定は、試料水のpHを約10 に調整した後,BT指示薬を加えて、EDTA溶洷 で滴定し




硬度1500mg Lのかた い水がある 水の硬度測定 バイオ科 応用バイオ化学実験 分析化学 2年 036 ブログ 学校のいまを知る 専門学校 東京テクニカルカレッジ



ご存知ですか 硬さ試験法 その1 ユニラボ 愛知 名古屋の理化学分析試験専門会社ユニケミー
陽イオンの価数に関係なく1:1で反応します.滴定に使用した既知濃度のEDTAの体積とモル濃度をV(m し )とC(mol/ し )とします.最初に分取した未知濃度の試料の体積とモル濃度をV'(m し )とC'(mol/ し )すると C'V'=CV ∴ C'=CV/V' 水の硬度 (ppm) 水1000 m し (=1000 g)中に存在するCa 2 とMg 2 のモル数の和が,それと同じモル数の炭酸カルシウムCaCO 3 式容量分析(キレート滴定によるCaの定量) <容量分析とはどのような分析法か> 酸-塩基の中和反応を例として、容量分析の原理を説明する 01mol/lのHClをビューレットにいれる 三角フラスコの中に、総量0001 mol となるよう、NaOH水溶液を入れる ex(01 mol/l のNaOH水溶液を( ) ml 分取すれば · キレート滴定の硬度の計算について考えています。 ミネラルウォーター50CM3を試料にEDTA溶液でキレート滴定をしたのですが、 硬度の計算がわからなかったため、知恵袋で検索していたところ、方法が2つ見つかりました。 ①硬度=(Caのモル濃度 (mol/l) Mgのモル濃度 (mol/l))× CaCO3の分子量 ②硬度=(Caのモル濃度+Mgのモル濃度)×100×1000(mg/L) ①と②の方法の




Amazon 硬度指示薬 25ml 水硬度チェッカー 軟水測定用 試薬 丸山製作所 メンテナンス用品 水栓工具




エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
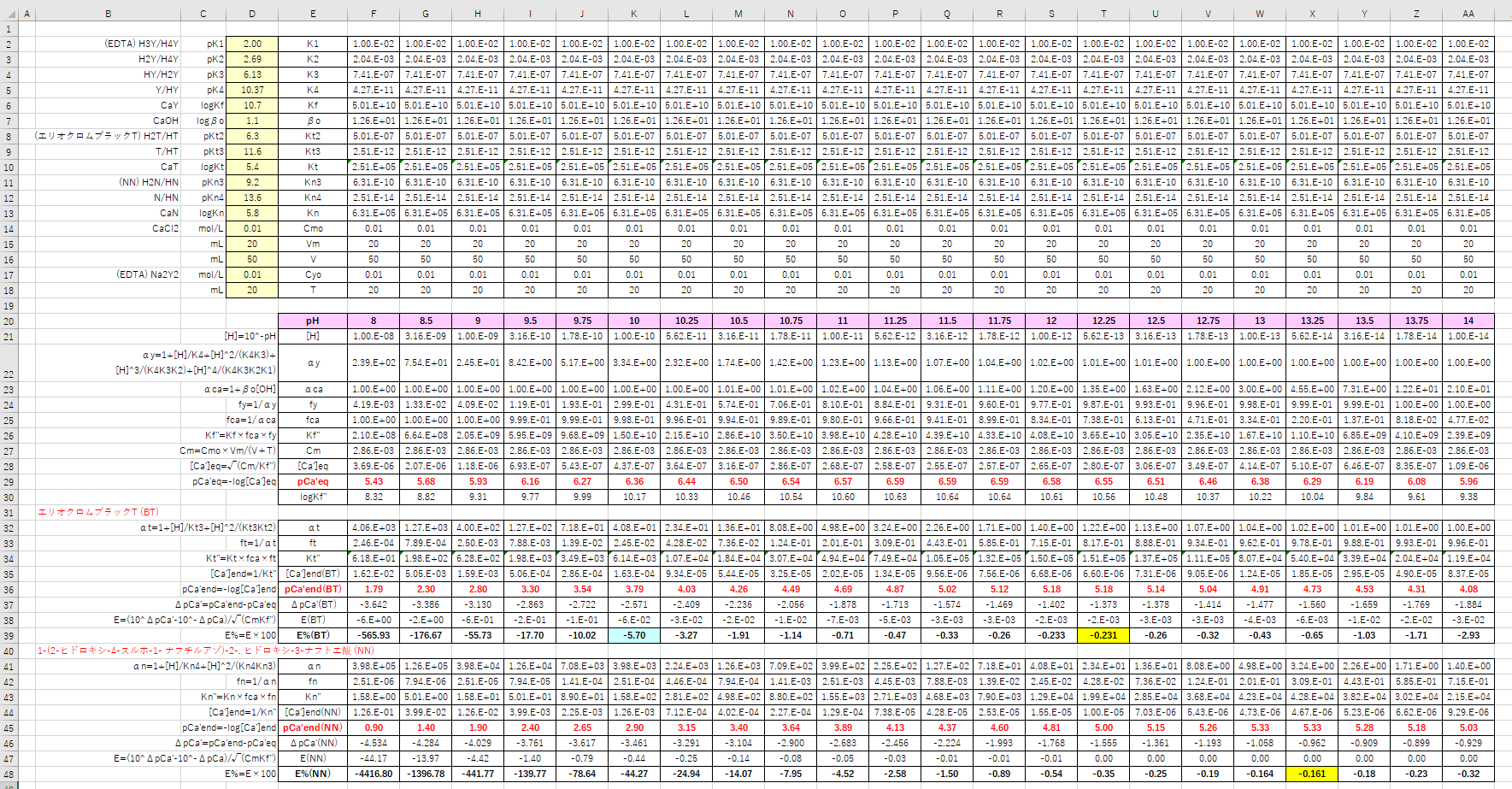



Edta 滴定曲線 溶解度などーエクセルを用いて




硬度1500mg Lのかた い水がある 水の硬度測定 バイオ科 応用バイオ化学実験 分析化学 2年 036 ブログ 学校のいまを知る 専門学校 東京テクニカルカレッジ




Woa1 Detergent Composition For Fibres Google Patents




硬度1500mg Lのかた い水がある 水の硬度測定 バイオ科 応用バイオ化学実験 分析化学 2年 036 ブログ 学校のいまを知る 専門学校 東京テクニカルカレッジ




Wo1791a1 Liquid Detergent Composition For Textile Products Google Patents




14 号 全硬度又はマグネシウム硬度の測定装置及び測定方法 Astamuse




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog




目 次 Pdf Free Download




水質q A 那覇市公式ホームページ




水質基準 試験用試薬 分析 製品情報 試薬 富士フイルム和光純薬




07 号 キレート剤の測定方法およびキレート剤の測定キット Astamuse



Fleece Zip 防寒 フルジップ Chums Full 東北 3 Offセール フリース チャムス レディース お家キャンプ 家キャン キャンプ フリース ベランピング チャムス Elmo パーカ チャムス フリース アウトドア モコモコ エルモ パーカー Parka 温かい ボアフリース




沈殿滴定 水道水中の塩化物イオン ファヤンス法 モール法 Transblog




分析実務たん Jis準拠 数式を書くのが面倒なので手書きで




Fleece Zip 防寒 フルジップ Chums Full 東北 3 Offセール フリース チャムス レディース お家キャンプ 家キャン キャンプ フリース ベランピング チャムス Elmo パーカ チャムス フリース アウトドア モコモコ エルモ パーカー Parka 温かい ボアフリース
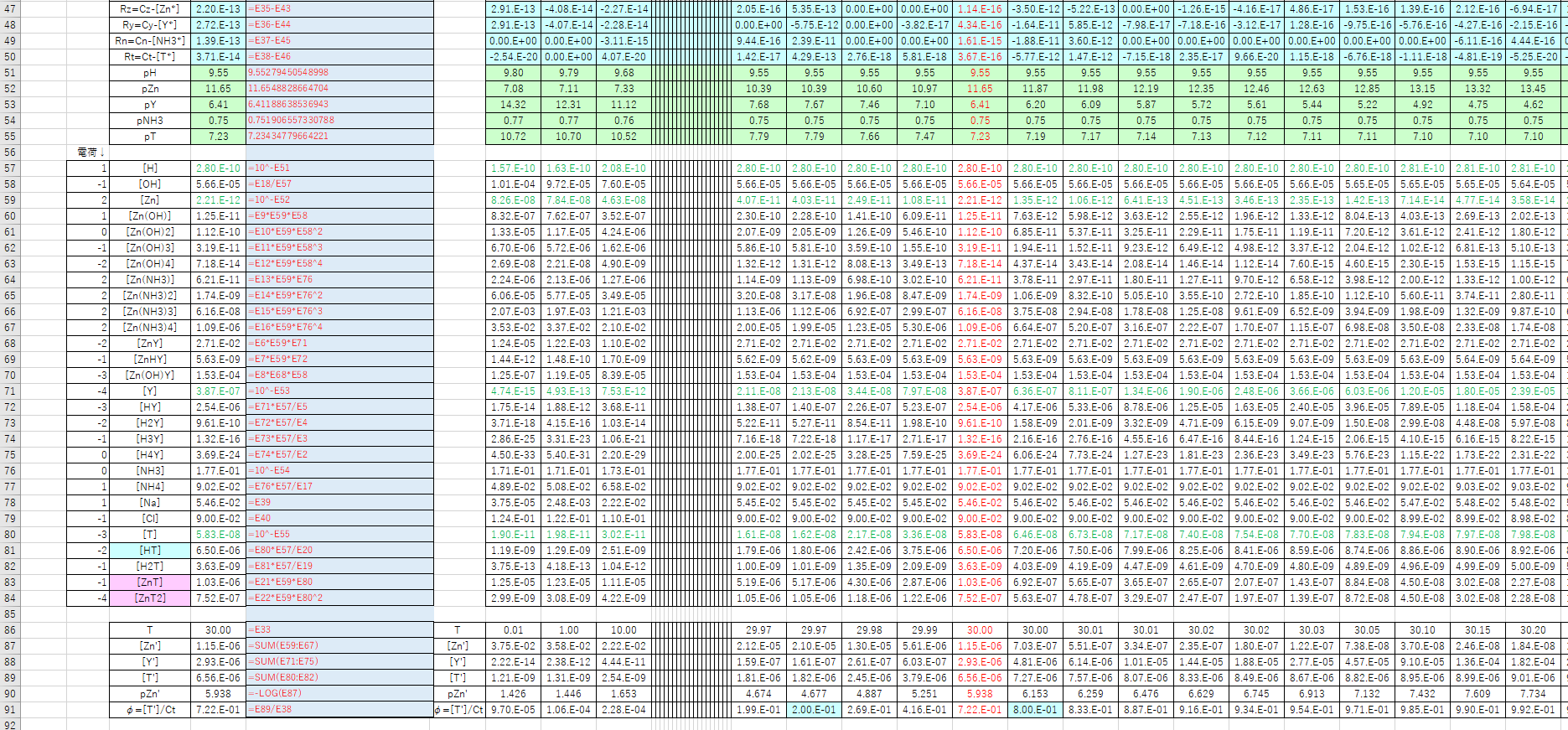



Edta 滴定曲線 溶解度などーエクセルを用いて



水の硬度 株式会社ユニケミー ユニラボ




Wo1791a1 Liquid Detergent Composition For Textile Products Google Patents




Images Of キレート滴定 Japaneseclass Jp




15 0105号 カルシウム硬度測定装置及び測定方法 Astamuse




遺伝子検査キット オッズ比から病気のリスクを知る方法 薬剤師が教える健康情報ブログ



0 件のコメント:
コメントを投稿